
请使用微信扫描二维码登陆
"药原素网"


近日,成都倍特药业按旧6类申报上市的盐酸替罗非班氯化钠注射液获批上市。该产品的上市申请于2015年12月7日获得CDE承办受理,受理号为CYHS1500939,2019年9月10日进入审批程序,9月30日处于“已发件”状态。
替罗非班是一种非肽类血小板糖蛋白Ⅱb/Ⅲa受体的可逆性拮抗剂,它能够阻止纤维蛋白原与糖蛋白Ⅱb/Ⅲa结合,进而阻断血小板的交联及血小板的聚集。
图1:2013-2018年中国公立医疗机构终端盐酸替罗非班销售情况(单位:万元)
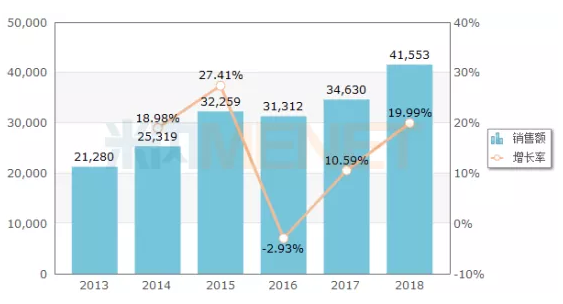
(来源:米内网中国公立医疗机构终端竞争格局)
据米内网数据,2018年中国公立医疗机构终端盐酸替罗非班(含盐酸替罗非班氯化钠注射液、盐酸替罗非班注射液、注射用盐酸替罗非班)销售额为4.16亿元,同比增长19.99%。除倍特药业外,目前国内市场还有8家药企拥有盐酸替罗非班氯化钠注射液的生产批文,包括红日药业、石四药、石药恩必普、鲁南贝特、远大医药等。
原料-制剂一体化,2个独家过评品种备战集采
表1:倍特药业已过评品种
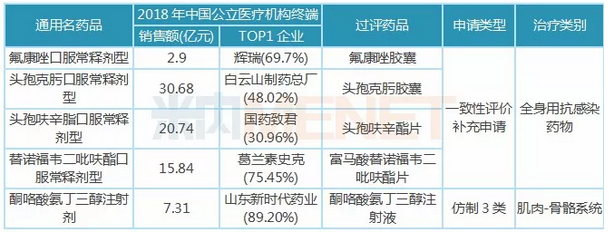
据米内网数据,目前倍特药业有5个品种通过或视同通过一致性评价,其中头孢呋辛酯片、富马酸替诺福韦二吡呋酯片为4+7集采品种,酮咯酸氨丁三醇注射液、头孢克肟胶囊、氟康唑胶囊为倍特独家过评品种。
在日前开展的4+7扩围集采中,倍特药业的富马酸替诺福韦二吡呋酯片以0.466/片的价格成功中选,获得甘肃、广西、贵州、宁夏、江苏、安徽、湖南、新疆(含兵团)8个省区的市场,合计采购额约474.8万元。
25个品种在4+7扩面集采中的降幅令人瞠目结舌,可以预见的是,未来仿制药将走向“拼成本”的时代,而原料药作为仿制药生产过程中成本占比最大的一环,是仿制药企业在集采中进行价格竞争必须考虑的关键因素。
而倍特药业恰好是原料-制剂一体化的代表企业,其全资子公司四川仁安药业是致力于高端原料药和中间体研发、生产和销售为一体的高科技创新型企业。目前已建设有四个生产车间、溶媒回收中心、动力中心、质检中心、污水处理中心、原料库、综合行政楼等。
表2:倍特药业获批生产的部分原料药
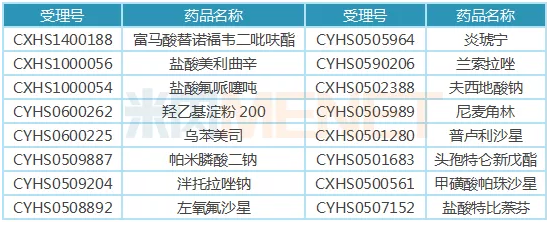
据米内网MED中国药品审评数据库2.0,目前倍特药业已有超过20个原料药获批生产,其中包括富马酸替诺福韦二吡呋酯,这也正是公司在4+7扩面集采中敢于报低价的原因之一。
业内普遍认为,在4+7集采扩区域之后,下一步就是扩品种,甚至有消息传出,在今年年底前,第二批带量采购的品种或将公布。酮咯酸氨丁三醇注射液、头孢克肟胶囊有望纳入集采名单,目前均由倍特药业独家过评。
酮咯酸氨丁三醇注射液可用于术后镇痛,目前国内市场有5家药企拥有该产品生产批文,倍特药业的产品按仿制药3类申报上市,获批生产后视同通过一致性评价,一旦该产品纳入集采,倍特药业将以“光脚企业”身份获益;头孢克肟胶囊为抗细菌药物,目前国内市场有24家药企拥有该产品生产批文,在2018年中国公立医疗机构终端头孢克肟口服剂型(含片剂、胶囊剂、分散片)中,倍特药业所占市场份额约13.8%,目前共有4家药企提交一致性评价补充申请,倍特药业率先过评。
4大注射剂有望首家过评,这些品种抢首仿
表3:倍特药业一致性评价在审情况
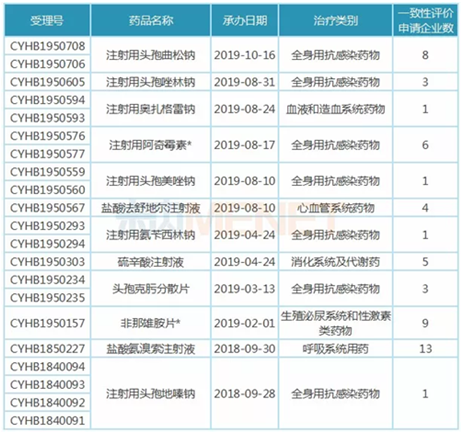
据米内网MED中国药品审评数据库2.0,截至目前,倍特药业向CDE提交一致性评价补充申请共计26个受理号(涉及16个品种),其中5个受理号(涉及4个品种)已顺利过评,均为全身用抗感染药物。此外还有21个受理号(涉及12个品种)处于“在审评审批中(在药审中心)”状态,其中有15个受理号(涉及7个品种)属于全身用抗感染药物。
由此可见,全身用抗感染药物是倍特药业重点聚焦的用药领域。据米内网数据,2018年中国公立医疗机构化学药终端全身用抗感染药物用药市场为1992.63亿元,同比增长3.59%。倍特药业一致性评价在审的7个全身用抗感染药物中,注射用头孢曲松钠、注射用头孢美唑钠、注射用头孢地嗪钠均为超20亿大品种。
注射用奥扎格雷钠、注射用头孢美唑钠、注射用氨苄西林钠、注射用头孢地嗪钠4个品种目前还未有企业通过或视同通过一致性评价,倍特药业独家申报一致性评价,有望首家过评。
表4:倍特药业按新注册分类申报上市的品种
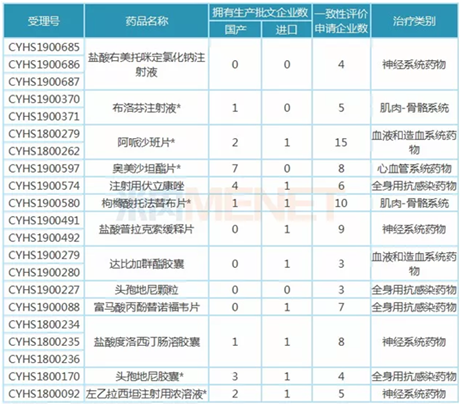
倍特药业有21个受理号(涉及13个品种)按新注册分类申报上市,其中7个品种目前还未有企业通过或视同通过一致性评价,盐酸右美托咪定氯化钠注射液、盐酸普拉克索缓释片、达比加群酯胶囊、头孢地尼颗粒、富马酸丙酚替诺福韦片5个品种目前还未有仿制药获批上市,首仿之争较为激烈。