请使用微信扫描二维码登陆
"药原素网"



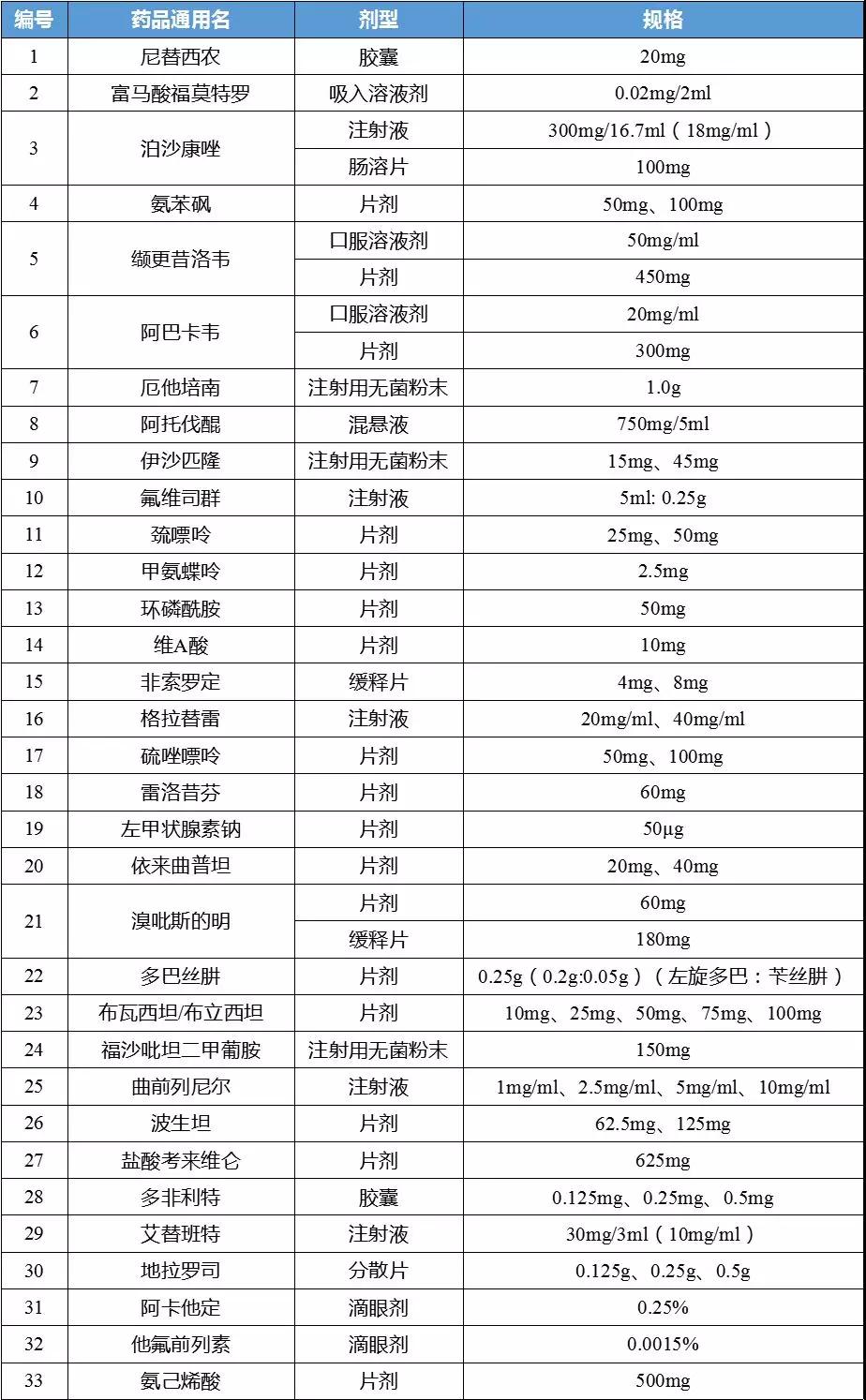
据了解,6月20日,卫健委官网曾公示第一批鼓励仿制药品目录建议清单,共公布了34个品种。业内专家指出,目录品种主要为国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)的药品,旨在引导企业研发、注册和生产。
抗HIV药物缺席正式名单
对比6月份的公示名单,正式名单中抗艾滋病药物利匹韦林(片剂,25mg)“缺席”,而其余6月份公布在列的33个药品在品规方面均无变动。
据了解,利匹韦林(商品名:恩临)由强生旗下的Tibotec公司开发,为新一代非核苷类反转录酶抑制剂。利匹韦林与美沙酮无明显的药物相互作用,能够满足HIV病毒感染/艾滋病患者中静脉注射吸毒人群的迫切需求。其与多款抗艾药物能够有效联合,其中吉利德公司推出的Odefsey(恩曲他滨/利匹韦林/替诺福韦艾拉酚胺)用药组合去年全球销售额超过15亿美元。
利匹韦林于2018年10月由西安杨森制药将其推入中国市场。目前,该药在国内暂无申报仿制药的厂家,亦未公布参比制剂。专家指出,对于仿制药来说,若无参比制剂就需要备案,对于参与竞争鼓励仿制名单的生产厂家来说,意味可能走弯路。而此次利匹韦林从正式名单中“不翼而飞”的原因尚不明确。
鼓励仿制药品目录常规化
此前,国家卫健委、国家发改委等12部门联合发布《关于加快落实仿制药供应保障及使用政策工作方案》,要求2019年6月底前发布第一批鼓励仿制的药品目录,以后每年年底都要发布鼓励仿制的药品目录。意味着鼓励仿制药品目录将从此“常规化”。
对此,业内人士指出,正式目录的落地,需要国家药监局、医保局和卫健委联手支持,给予企业更多优惠,将鼓励落到实处。“目录中出现的产品,要么存在技术壁垒,要么是市场冷门的孤儿品种,需要投入大量资金攻克技术难关。但若企业看不到预期利益,则很难产生投入研发的积极性。”
同时,也有专家指出,企业需要警惕研发“黑箱期”造成撞车:“目录上的药品目前来看,或是无剂型供应,或是无此种产品,在市场上处于空白或短缺状态。但是考虑到企业在研发初期秘而不宣,到申报临床试验时才回挂网公示——如若出现研发扎堆现象,需在5、6年后才发现竞争者甚众。而此时企业已投入巨资研发,进退两难。”
其指出,监管部门应充分发挥“看不见的手”的调控作用,改善市场信息不对称的问题,使市场信息透明化,防止造成恶性竞争和资源浪费。
第一批鼓励仿制药品目录